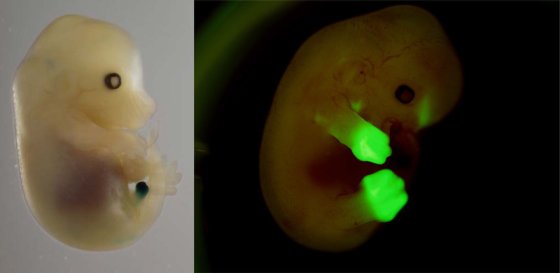
Spécialiste en génétique moléculaire et biologie développementale, Denis Duboule s’intéresse tout particulièrement aux mécanismes de régulation génétique qui régissent l’expression des gènes et le développement embryonnaire.
Professeur invité sur la chaire internationale Évolution des génomes et développement depuis 2017, il devient titulaire en 2022 de la chaire Évolution du développement et des génomes.
Comment en êtes-vous arrivé à vous intéresser au domaine de la biologie moléculaire ?
Denis Duboule : Ayant grandi à la campagne, j'ai toujours aimé la nature et les animaux. Lors de mes études de biologie, je me suis d’abord tourné vers les plantes et les champignons, parce que j'ai un goût pour les classifications – la biologie à l’ancienne. Puis, petit à petit, j'en suis arrivé à l'embryologie qui, pourtant, ne m’attirait pas vraiment à l'université, car tout y semblait compliqué. Quand on s'y intéresse de plus près, cependant, presque par obligation d'examen, on s'aperçoit que c’est une discipline d'une richesse conceptuelle et historique inépuisable. Après mon doctorat, je suis allé à Strasbourg chez le Pr Pierre Chambon, qui a ensuite enseigné au Collège de France. Au bout de quelques mois, il a reçu un manuscrit inédit, écrit par un chercheur de Bâle, Walter Gehring, qui avait fait une découverte incroyable relative aux gènes du développement chez la mouche drosophile. Pierre Chambon était persuadé que ces gènes et leurs fonctions existaient aussi chez les vertébrés, alors il m'a proposé de créer un groupe sur ce sujet. Je n'avais pas une très bonne idée de ce dont il s'agissait, néanmoins, j'étais intrigué, et nous avons donc commencé à travailler avec ces gènes dans un environnement scientifique extraordinaire. Il faut bien comprendre que les quinze dernières années du siècle passé, la fête était permanente en biologie du développement et en génétique. Chaque année, de nouveaux résultats incroyables tombaient, jusqu'au séquençage des génomes au passage du millénaire. Je ne sous-entends pas que la période actuelle n'est pas aussi riche, et ne me confonds pas en nostalgie. Mais il y a eu un tournant, une rencontre entre deux mondes : la biologie du développement – une science avant tout expérimentale, presque de la cuisine avec ses recettes manuelles – et la génétique, qui est d’une approche plus intellectuelle, plus abstraite. Deux états d'esprit d’apparence opposés, qui se sont rejoints grâce à la biologie moléculaire. C’est là qu’on a commencé à comprendre que des gènes contrôlent le développement des embryons.
Comment expliquer les années de circonspection qui ont suivi la découverte de ce mécanisme chez la drosophile ?
Quand le premier gène Hox de vertébré – issu d'une grenouille – ressemblant à ceux de la mouche est apparu, il devint clair que les animaux partageaient des gènes similaires. Pourtant, il fallut encore quelques années pour comprendre que l’organisation générale de ce réseau génétique essentiel pour fabriquer le corps était conservée entre les vertébrés et les invertébrés – que les mêmes règles fondamentales étaient à l’œuvre. Cela ne faisait que préfigurer l’analyse des génomes à la fin du siècle passé, qui montra que, si des différences claires existaient entre les génomes d’espèces distinctes, le nombre de gènes et la façon dont ils sont régulés étaient très similaires entre les espèces. Nous portons en nous l’histoire des animaux. Le prix Nobel de médecine de 1965, le biologiste français François Jacob, le disait déjà dans les années 1970. À l'époque, on pensait que les éléphants avaient une trompe, car ils possédaient un gène de la trompe. Cette conception était entretenue par une vision biaisée de l’évolution et de la génétique qui associait un gène à une caractéristique propre. Mais cela ne fonctionne pas comme ça. Alors, si nous avons les mêmes gènes que l'éléphant, pourquoi n'avons-nous pas de trompe ? C'est un renversement de la question qui nous a conduits à nous demander : comment se fait-il que les animaux soient si différents les uns des autres, alors qu’ils partagent tellement de leur ADN ? Un champ de recherche incroyable s’est ouvert à cette époque, toujours en chantier.